Atomes, molécules et ions
Les atomes
Toute la matière solide, liquide ou gazeuse de l’Univers est constituée à partir de particules minuscules appelées les atomes.
La taille d’un atome est de l’ordre du dix-millionième de millimètre. Il y a donc environ 12 500 000 000 000 000 000 000 000 atomes dans un verre d’eau (1,25 × 1025 atomes).
Il existe 118 types d’atomes différents1. On a attribué à chacun d’entre eux un nom et un symbole chimique constitué d’une lettre majuscule parfois suivie d’une seconde lettre minuscule2.
Toutes ces informations sont regroupées dans un tableau qu’on appelle le tableau périodique des éléments. Les atomes y sont classés par numéros atomiques croissants et groupés en colonnes selon leurs propriétés chimiques. Selon les versions, ce tableau inclut plus ou moins d‘informations.
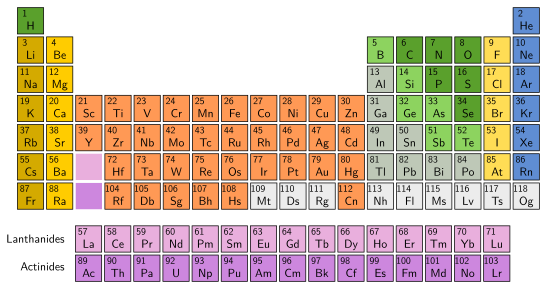
Seuls quelques types d’atomes et leur symbole chimique sont à connaître au collège :
| Nom | Carbone | Hydrogène | Oxygène | Azote |
|---|---|---|---|---|
| Symbole chimique | C | H | O | N |
Et éventuellement…
| Nom | Chlore | Cuivre | Fer | Sodium | Zinc |
|---|---|---|---|---|---|
| Symbole chimique | Cl | Cu | Fe | Na | Zn |
Les molécules
Les atomes se lient entres eux et forment des assemblages qu’on appelle des molécules.
Les atomes ne peuvent pas se lier entre eux n’importe comment. Chaque type d’atome peut faire une certain nombre de liaisons avec ses atomes voisins3. Il existe néanmoins une infinité de combinaisons possibles (les plus petites molécules sont des assemblages de 2 atomes mais les plus grandes peuvent en comporter des centaines de millions).
Modèles moléculaires
Pour représenter une molécule, on utilise des modèles moléculaires dans lesquels chaque atome est modélisé par une sphère de couleur4.
Le code de couleur suivant est généralement utilisé :
| Nom | Carbone | Hydrogène | Oxygène | Azote |
|---|---|---|---|---|
| Modèle moléculaire |  |
 |
 |
 |
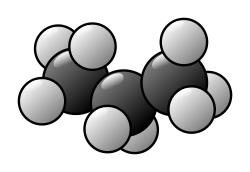
Par exemple, le propane est une molécule qui consiste en un assemblage de trois atomes de carbones liés à huit atomes d’hydrogène. Son modèle moléculaire est le suivant :
Formules chimiques
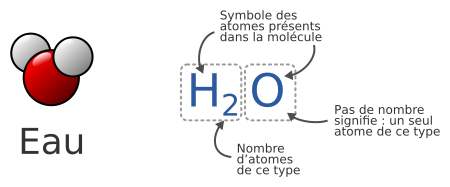
La composition d’une molécule, c’est-à-dire le nombre d’atomes qu’elle contient et leur type est indiquée dans leur formule chimique.
La formule chimique est une expression dont l’écriture suit les règles suivantes :
- on écrit l’un après l’autre les symboles des types d’atome présents dans la molécule (par ordre alphabétique5) ;
- on ajoute un nombre indiquant combien d’atomes de ce type se trouvent dans la molécule en indice de chaque symbole (si ce nombre vaut 1, on ne le note pas).
Par exemple, l’eau est une molécule qui contient un atome d’oxygène lié à deux atomes d’hydrogène, sa formule chimique est H2O :
Molécules simples à connaître
Quelques molécules simples sont à connaître au collège. Il faut être capable d’associer leur nom à leur formule et à leur modèle moléculaire.
| Nom | Eau | Diazote | Dihydrogène | Dioxygène |
|---|---|---|---|---|
| Modèle moléculaire |  |
 |
 |
 |
| Formule chimique | H2O | N2 | H2 | O2 |
| Nom | Protoxyde d’azote | Dioxyde de carbone | Méthane |
|---|---|---|---|
| Modèle moléculaire |  |
 |
 |
| Formule chimique | N2O | CO2 | CH4 |
Les ions
Un ion est un atome (ou une molécule6) qui a gagné ou perdu un ou plusieurs électrons.
Si l’atome (ou la molécule) dont est issu l’ion a perdu un ou des électrons, l’ion obtenu a une charge électrique positive7. On appelle ces ions positifs des cations.
À l’inverse, si l’atome (ou la molécule) dont est issu l’ion a gagné un ou des électrons, l’ion obtenu a une charge électrique négative. On appelle ces ions négatifs des anions.
La formule chimique d’un ion est la formule chimique de l’atome ou de la molécule de départ à laquelle on ajoute le nombre de charges électriques et leur signe en exposant (en haut à droite de la formule chimique). Si le nombre de charges est égale à 1, on n’indique pas le 1 mais on indique tout de même le signe de la charge.
Voici quelques ions à connaître (formule et nom) :
| Nom | Cuivre | Fer II (ferreux) | Fer III (ferrique) | Chlorure | Hydrogène | Hydroxyde |
|---|---|---|---|---|---|---|
| Formule chimique | Cu2+ | Fe2+ | Fe3+ | Cl– | H+ | HO– |
Et éventuellement…
| Nom | Zinc | Sodium | Sulfate |
|---|---|---|---|
| Formule chimique | Zn2+ | Na+ | SO42– |
Les espèces chimiques
Une espèce chimique peut désigner :
- soit un ensemble d’atomes identiques (par exemple l’or dont la formule est Au) ;
- soit un ensemble de molécules identiques (par exemple l’eau de formule H2O) ;
- soit un ensemble d’ions identiques (par exemple le chlorure de formule Cl–) ;
- soit un composé ionique, c’est-à-dire l’association de cations et d’anions formant une espèce neutre (par exemple la soude de formule (Na+ + HO–) ou NaOH).
Notes
-
Il existe 118 types d’atomes connus par l’être humain. Sur ces 118 types, 94 existent à l’état naturel sur Terre. ↩
-
Les symboles ont été adoptés au début du XIXe en prenant la première lettre du nom latin de l’atome. Comme le nombre de lettres dans l’alphabet n’est pas suffisant, une deuxième lettre minuscule a été ajoutée pour certains atomes. ↩
-
Par exemple, l’atome d’hydrogène peut faire une seule liaison avec un autre atome. L’atome d’oxygène peut se lier à un ou deux autres atomes. L’atome de carbone peut se lier à un, deux, trois ou quatre autres atomes… ↩
-
Pour des raisons de clarté, les atomes sont parfois représentés par des sphères plus petites et les liaisons entre les atomes sont représentées par des bâtons. ↩
-
L’ordre des symboles chimiques dans une formule chimique n’est pas toujours l’ordre alphabétique. Parfois l’ordre est changé pour donner une information supplémentaire (par exemple : dans quel ordre les atomes sont liés, sur quel atome se trouve la charge électrique de l’ion…). ↩
-
Dans le cas d’un ion obtenu à partir d’un atome, on parle d’ion monoatomique. ↩
-
Un atome ou une molécule est neutre électriquement (sa charge électrique vaut 0). Si on retire un électron chargé négativement, la charge de l’ion obtenu est positive. ↩