Les réactions chimiques

Que se passe-t-il au niveau microscopique lors d’une transformation chimique ?
Pour comprendre ce qui se passe au niveau microscopique, on va partir de l’exemple de la combustion du charbon. Il va falloir s’intéresser à ce qui se passe au niveau des molécules et des atomes.
Le bilan de la combustion du charbon est :
carbone + dioxygène → dioxyde de carbone
Cela signifie que des molécules de dioxygène vont disparaître (en réagissant) alors que des molécules de dioxyde de carbone vont apparaître. On peut modéliser cela avec des modèles moléculaires.
Modélisation des molécules
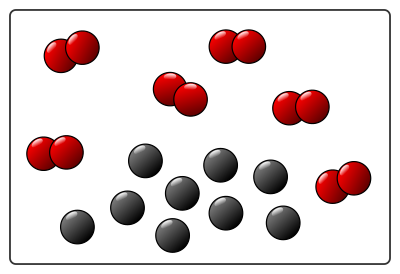
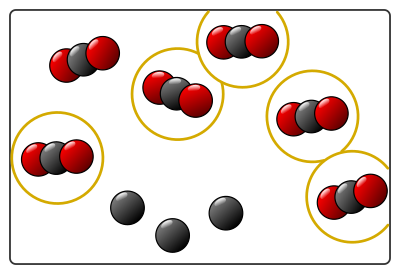
Lors de la combustion réelle du charbon, des milliards de milliards de molécules vont réagir. Pour simplifier, on n’en représente que quelques unes : par exemple 6 molécules de dioxygène et 9 atomes de carbone.
Attention : pour la modélisation, il faut se rappeler que lors d’une transformation chimique, il y a conservation de la masse. Au niveau microscopique, cela signifie que le nombre d’atomes de chaque type ne change pas.
Lors d’une transformation chimique, il y a conservation du nombre et du type d’atomes.
Voici un schéma des réactifs au niveau microscopique (il faut imaginer qu’en réalité toutes ces molécules bougent dans tous les sens et s’entrechoquent…) :
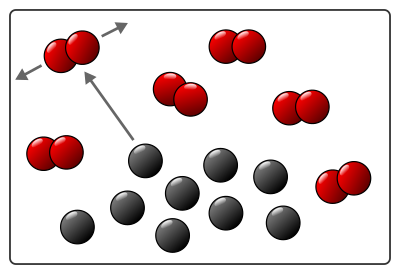
En entrant en collision, les atomes des réactifs se séparent (les molécules se « cassent ») et s’assemblent différemment pour former les molécules des produits.
Les réactifs continuent à entrer en collision et former les molécules des produits jusqu’à ce qu’il n’y ait plus assez de molécules de réactif pour former les produits.
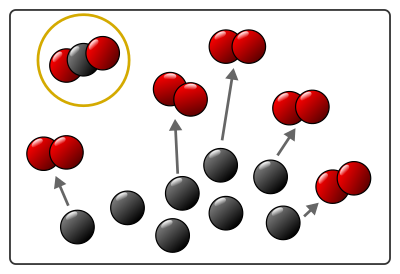
À la fin de la combustion représentée sur le schéma, il n’y a plus de molécule de dioxygène, donc plus d’atomes d’oxygène pour former les molécules de dioxyde de carbone. La transformation s’arrête. Il reste des réactifs qui n’ont pas réagit (ici 3 carbones).
Pour résumer :
- les 6 molécules de dioxygène de départ ont disparu ;
- 6 atomes de carbone (sur les 9 de départ) ont disparu ;
- 6 molécules de dioxyde de carbone sont apparues.
Il y a autant de molécules de dioxygène et d’atomes de carbone qui réagissent et cela a produit autant de molécules de dioxyde de carbone.
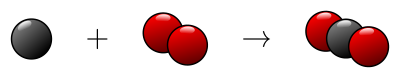
Au final on en conclut donc qu’au niveau microscopique, lors de la combustion du charbon, chaque atome de carbone réagit avec une molécule de dioxygène pour former une molécule de dioxyde de carbone :
Équation de la réaction
Pour simplifier l’écriture de ce qui se passe au niveau microscopique lors de la transformation chimique, on va remplacer les dessins des modèles moléculaires par les formules chimiques (carbone : C, dioxygène : O2 et dioxyde de carbone : CO2). De plus, on va indiquer devant chaque formule chimique combien de fois la molécule apparaît :
1 C + 1 O2 → 1 CO2
Pour encore simplifier, on n’écrit pas le nombre de molécules devant la formule dans le cas où il n’y en a qu’une !
On obtient ce qu’on appelle l’équation de la réaction :
C + O2 → CO2
Cette équation signifie : « un atome de carbone réagit avec une molécule de dioxygène pour former une molécule de dioxyde de carbone ».
Équilibrer une équation de réaction
Trouver l’équation de réaction à partir des modèles moléculaires peut être long et fastidieux. On peut aller beaucoup plus vite et trouver cette équation directement à partir du bilan de la transformation.
Rien ne se perd…
Pour cela, il faut à nouveau se rappeler que lors d’une transformation chimique, il y a conservation des atomes.
Pour trouver l’équation d’une réaction, il suffit donc d’ajuster le nombre de molécules des réactifs et des produits pour que l’équation soit équilibrée (c’est-à-dire qu’il y ait le même nombre d’atomes de chaque type au début et à la fin de la transformation, donc de part et d’autre de la flèche).
Exemple
Prenons par exemple la combustion du méthane dont le bilan est :
méthane + dioxygène → dioxyde de carbone + eau
On trouve l’équation de la réaction en suivant les étapes suivantes…
-
On remplace les noms des réactifs et des produits par leurs formules chimiques :
CH4 + O2 → CO2 + H2O
-
On compte les atomes de carbone dans les réactifs (à gauche de la flèche) et ceux des produits (à droite de la flèche).
Il y a un carbone à gauche (1 dans CH4) et un à droite (1 dans CO2) donc l’équation est équilibrée pour le carbone. On ne change rien :
CH4 + O2 → CO2 + H2O
-
On compte les atomes d’hydrogène. Il y en a quatre à gauche (4 dans CH4) et deux à droite (2 dans H2O). Ce n’est pas bon car il doit y en avoir le même nombre. Il en manque donc deux à droite. Pour les rajouter, on ajoute une molécule d’eau entière à droite. Comme il y avait déjà une molécule d’eau, ça en fait deux :
CH4 + O2 → CO2 + 2 H2O
-
On compte maintenant les atomes d’oxygènes. Il y en a deux à gauche (2 dans O2) et quatre à droite (2 dans CO2 et 1 dans chacun des deux H2O). Ce n’est pas équilibré. Cette fois il manque deux atomes d’oxygène à gauche. Pour les rajouter, on ajoute une molécule de dioxygène entière à gauche. Il y en avait déjà une, donc ça en fait maintenant deux :
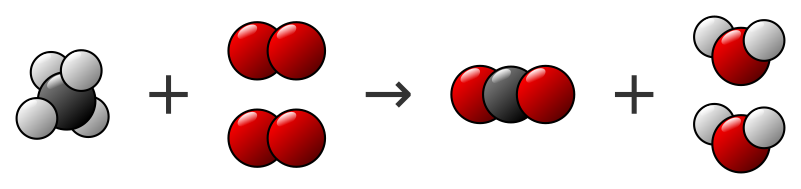
CH4 + 2 O2 → CO2 + 2 H2O
-
L’équation est équilibrée. On a ajusté le nombre de molécules des réactifs et des produits. Il y a le même nombre d’atomes de chaque type à gauche et à droite de la flèche (c’est-à-dire au début et à la fin de la transformation).
On peut le vérifier en recomptant les atomes ou en vérifiant sur un modèle moléculaire :
Et avec les ions ?
Lorsqu’on ajuste une équation de réaction dans laquelle interviennent des ions, on procède de la même façon qu’avec les molécules. Il faut juste s’assurer que la charge électrique totale des réactifs soit la même que la charge électrique totale des produits.
Lors d’une transformation chimique, il y a conservation de la charge électrique totale.
Par exemple, la réaction de l’acide chlorhydrique avec le fer a comme équation de réaction :
Fe + 2 H+ → Fe2+ + H2
On remarque que l’équation est équilirée du point de vue des atomes mais également des charges électriques (2 charges + dans les réactifs et 2 charges + dans les produits).
Autre exemple. L’autoprotolyse de l’eau a comme équation de réaction :
H2O → H+ + HO–
Là aussi l’équation est équilirée du point de vue des atomes mais également des charges électriques (le réactif est neutre et la charge + et la charge – des produits s’annulent).
Remarque : si on ajuste correctement une équation de réaction du point de vue des atomes, l’équation est automatiquement équilibrée du point de vue des charges.