L’origine microscopique de l’acidité

Les ions hydrogène et hydroxyde
L‘acidité et la basicité sont liées à la présence de deux ions particuliers : l’ion hydrogène de formule chimique H+ et l’ion hydroxyde de formule chimique HO–.
Le pH d’une solution est lié aux proportions d’ions H+ et HO– présents :
- s’il y a autant d’ions H+ que d’ions HO–, la solution est neutre et le pH vaut 7 ;
- s’il y a plus d’ions H+ que d’ions HO–, la solution est acide et le pH est inférieur à 7. Pour un même volume, plus le nombre d’ions H+ est grand, plus la solution est acide et le pH proche de 0.
- s’il y a plus d’ions HO– que d’ions H+, la solution est basique et le pH est supérieur à 7. Pour un même volume, plus le nombre d’ions HO– est grand, plus la solution est basique et le pH proche de 14.
Soude et acide chlorhydrique
La soude est une solution aqueuse contenant autant d’ions hydroxyde que d’ions sodium. La formule chimique de la solution se note (Na+ + HO–).
L’acide chlorhydrique est une solution aqueuse contenant autant d’ions hydrogène que d’ions chlorure. La formule chimique de la solution se note (H+ + Cl–).
Quelques exemples
Dans les exemples suivants, la taille des ions est évidemment exagérée et leur nombre réduit par rapport à la réalité…
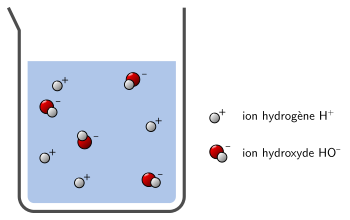
Dans l’exemple ci-dessous, la solution est neutre car il y a autant d’ions H+ que d’ions HO– :
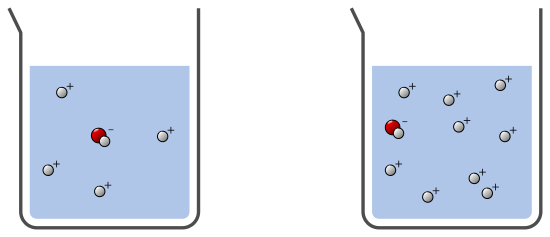
Dans l’exemple suivant, les deux solutions sont acides, il y a plus d’ions H+ que HO–. Par contre, la solution de droite est plus acide que celle de gauche car pour un même volume, il y a plus d’ions H+ dans la solution de droite :
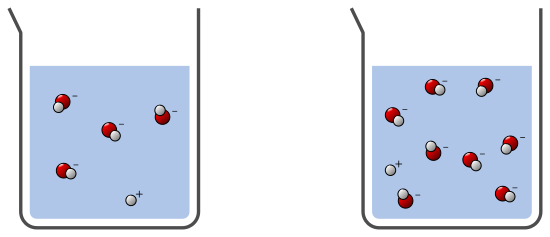
Dans ce troisième exemple, les deux solutions sont basique, il y a plus d’ions HO– que H+–. La solution de droite est plus basique que celle de gauche car pour un même volume, il y a plus d’ions HO– dans la solution de droite :
Pour ce dernier exemple, les deux solutions sont acides. Elles contiennent le même nombre d’ions H+ mais celle de droite est plus acide car les ions H+ sont concentrés dans un volume plus faible :
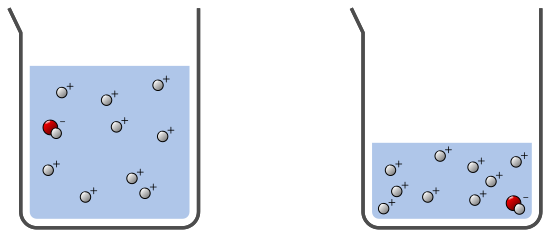
Remarque : dans tous les cas, les solutions sont neutres électriquement1, les charges des ions positifs et négatifs sont compensées par les charges d’autres ions non représentés (par exemple des ions chlorure ou sodium…).
Mélanges entre acides et bases
Lorsqu’on mélange un acide avec une base, les ions hydrogène réagissent avec les ions hydroxyde pour former de l’eau selon l’équation :
H+ + HO– → H2O
Cela signifie que les ions hydrogène et hydroxyde se neutralisent.
Par exemple : si on ajoute une base dans un acide, la solution devient de moins en moins acide. Si on continue d’ajouter la base, il arrive un moment où il y a autant d’ions H+ que HO– et la solution devient neutre. Si on continue encore d’ajouter la base, la solution deviendra de plus en plus basique…
Notes
-
Attention à ne pas confondre « neutre électriquement » qui signifie qu’il y a autant de charges électriques positives que de charges électriques négatives, et « neutre chimiquement » qui signifie que la solution n’est ni acide ni basique. ↩