Les tests d’identification

Les tests d’identification permettent d’identifier la présence de certaines substances. L’ajout d’un réactif entraîne une réaction chimique avec la substance à identifier (si elle est présente !). La transformation chimique produit un effet visuel (changement de couleur, etc.) qui permet de la repérer facilement et donc de savoir si le test est positif.
Au collège, plusieurs tests d’identification sont à connaître :
- celui de l’eau ;
- celui du dioxyde de carbone ;
- celui du dioxygène ;
- ceux de quelques ions ;
- celui du dihydrogène.
Ils sont qualitatifs, c’est-à-dire qu’ils permettent de savoir si la substance recherchée est présente mais ils ne permettent pas de savoir en quelle quantité.
Identification de l’eau
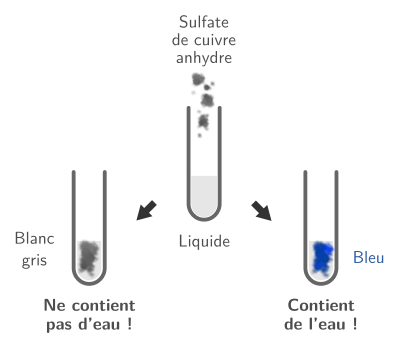
Pour identifier la présence d’eau, on utilise du sulfate de cuivre anhydre. Il s’agit d’une poudre grise ou blanche. En présence d’eau, le sulfate de cuivre anhydre change de couleur, il devient bleu.
Pour tester la présence d’eau dans une substance, on ajoute un peu de sulfate de cuivre anhydre (ou on verse un peu de la substance sur du sulfate de cuivre anhydre) et on observe le changement de couleur :
- si le mélange devient bleu, la substance était ou contenait de l’eau ;
- s’il n’y a pas de changement de couleur, la substance ne contient pas d’eau.
 Attention : le sulfate de cuivre anhydre est toxique, il faut donc le manipuler avec des lunettes de
protection. Il est également dangereux pour l’environnement, il ne faut donc pas le jeter à l’évier : il doit être
récupéré dans un bidon spécial.
Attention : le sulfate de cuivre anhydre est toxique, il faut donc le manipuler avec des lunettes de
protection. Il est également dangereux pour l’environnement, il ne faut donc pas le jeter à l’évier : il doit être
récupéré dans un bidon spécial.
La formule chimique du sulfate de cuivre anhydre est CuSO4. En solution, les ions cuivre et sulfate se dissocient pour donner : (Cu2+ + SO42–). La réaction chimique qui a lieu lors du test est la suivante :
Cu2+ + 5 H2O → [Cu(H2O)5]2+
Les ions sulfate sont spectateurs dans cette réaction.
Identification du dioxyde de carbone
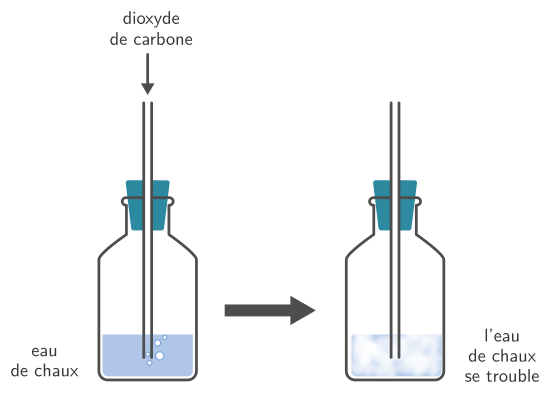
Pour identifier le dioxyde de carbone, on utilise de l’eau de chaux. L’eau de chaux est un liquide incolore qui se trouble et devient blanc en présence de dioxyde de carbone.
Pour savoir si un gaz est du dioxyde de carbone, il faut donc le faire passer dans de l’eau de chaux (ou le mettre le gaz en contact avec la surface de l’eau de chaux et éventuellement agiter).
La réaction chimique qui a lieu lors du test est la suivante :
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 est l’hydroxyde calcium qui se trouve dans l’eau de chaux et CaCO3 est le carbonate de calcium qui se forme. Le carbonate de calcium est un solide blanc, il est responsable de l’aspect blanchâtre quand l’eau de chaux se trouble.
Un solide qui se forme dans une solution s’appelle un précipité.
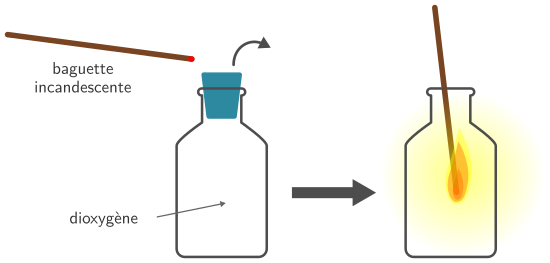
Identification du dioxygène
Le dioxygène est un comburant. On teste donc sa présence en introduisant une baguette incandescente (qui brûle sans faire de flamme) dans le récipient. La baguette se rallume et brûle vivement en présence de dioxygène, sinon elle s’éteint.
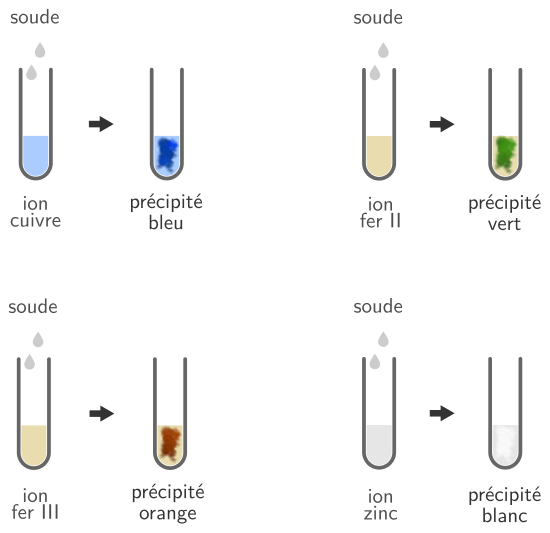
Identification de quelques ions
Plusieurs ions métalliques réagissent avec la soude pour former un précipité coloré qui permet de les identifier.
-
L’ion cuivre Cu2+ réagit avec la soude et forme un précipité bleu (appelé l’hydroxyde de cuivre) selon la réaction :
Cu2+ + 2 HO– → Cu(OH)2
-
L’ion fer II (ou ion ferreux) Fe2+ réagit avec la soude et forme un précipité vert (appelé l’hydroxyde de fer II ou hydroxyde ferreux) selon la réaction :
Fe2+ + 2 HO– → Fe(OH)2
-
L’ion fer III (ou ion ferrique) Fe3+ réagit avec la soude et forme un précipité orange (appelé l’hydroxyde de fer III ou hydroxyde ferrique) selon la réaction :
Fe3+ + 3 HO– → Fe(OH)3
-
L’ion zinc Zn2+ réagit avec la soude et forme un précipité blanc (appelé l’hydroxyde de zinc) selon la réaction :
Zn2+ + 2 HO– → Zn(OH)2
L’ion chlorure peut être identifier en le faisant réagir avec du nitrate d’argent. Il se forme alors un précipité blanc qui noircit à la lumière.
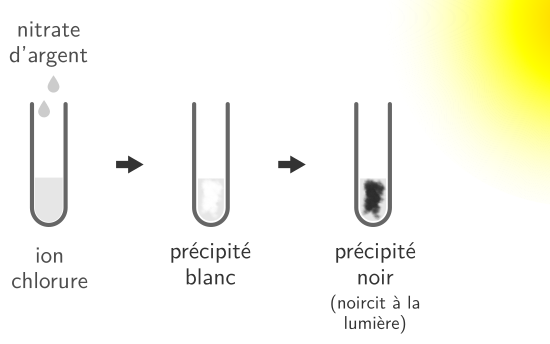
Le précipité produit est du chlorure d’argent (AgCl). La réaction chimique correspondante est :
Cl– + Ag+ → AgCl
Identification du dihydrogène
Le dihydrogène explose avec un bruit caractéristique (un « wooof » aigü) en présence d’une flamme et de dioxygène (le dioxygène de l’air).
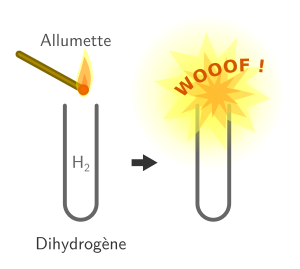
La réaction chimique qui a lieu lors du test est la suivante :
2 H2 + O2 → 2 H2O