Les états de la matière
De nombreuses substances, telles que l’eau par exemple, peuvent se trouver sous différentes formes qu’on appelle des états de la matière (ou états physiques).
Les principaux états de la matière
Les trois principaux états de la matières qui concernent la majorité des substances sont l’état solide, l’état liquide et l’état gazeux1.
Ces trois états de la matière ont des particularités qui permettent de les identifier à notre échelle. Ces particularités sont liés à l’organisation de la matière à l’échelle microscopique.
Un solide a une forme propre2 et un volume propre.
Un liquide n’a pas de forme propre, il prend la forme de son récipient. Il a un volume propre et possède une surface libre au repos qui est plane et horizontale.
Un gaz3 n’a ni forme propre ni volume propre. Il occupe tout le volume disponible. De plus, un gaz est compressible et expansible.
Les changements d’état
On peut faire passer une substance d’un état de la matière à un autre en modifiant sa température4.
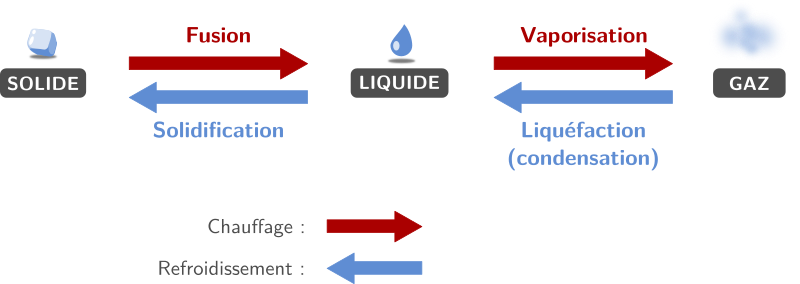
Les noms des changement d’état sont :
- fusion pour le passage de solide à liquide (en chauffant).
- vaporisation pour le passage de liquide à gazeux (en chauffant). La vaporisation peut se faire par ébullition (le gaz se forme à l’intérieur du liquide) ou par évaporation (le gaz se forme à la surface du liquide).
- liquéfaction pour le passage de gazeux à liquide (en refroidissant). On peut aussi appeler ce changement la condensation ou pour être plus précis : la condensation liquide.
- solidification pour le passage de liquide à solide (en refroidissant).
On peut aussi directement passer du solide au gaz (sans passer par la forme liquide) : c’est la sublimation. Et inversemment, on peut passer du gaz au solide directement, c’est la condensation solide.
Les températures de changement d’état
Lorsqu’on chauffe ou refroidit un corps pur, on constate que la température atteint un palier pendant toute la durée du changement d’état.
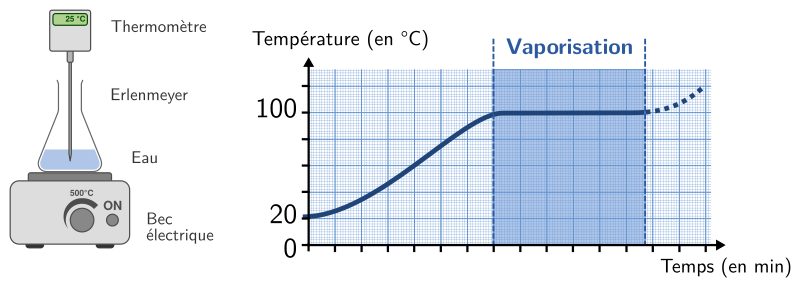
La température du palier auquel a lieu la vaporisation est la même que celle du palier auquel a lieu la liquéfaction. Cette température s’appelle la température d’ébulltion qu’on note souvent Tb.
De la même façon, la température du palier auquel a lieu la fusion est la même que celle du palier auquel a lieu la solidification. Cette température s’appelle la température de fusion qu’on note souvent Tf.
Chaque corps pur a ses propres températures de fusion et d’ébullition. On peut même se servir de ces températures pour identifier une substance.
Dans le cas de l’eau, la température de fusion vaut 0° C et la température d’ébullition vaut 100° C.
Dans le cas des mélanges, la variation de température est modifiée lors du changement d’état mais il n’y a pas de palier.
Conservation
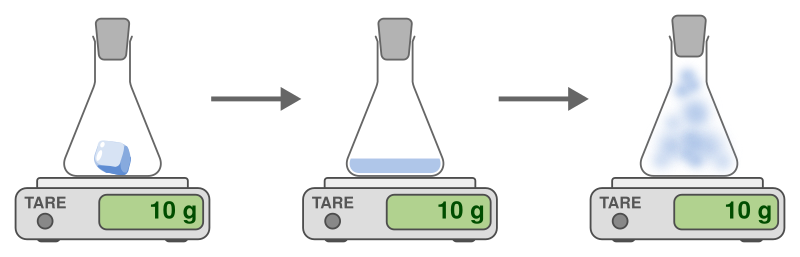
Lors d’un changement d’état, la masse de la substance ne change pas. On dit qu’il y a conservation de la masse.
Notes
-
Le quatrième état de la matière le plus courant est l’état plasma. Il s’agit d’un état dans lequel les électrons se détachent des atomes ou molécules, formant une sorte de soupe d’électrons et d’ions. ↩
-
La forme d’un solide peut être plus ou moins modifiée sous l’effet de contraintes, selon le type de solide (par exemple l’or ou la pâte à modeler se déforment plus facilement que l’acier). ↩
-
On peut aussi parler de vapeur au lieu de gaz. ↩
-
On peut aussi modifier la pression ou le volume d’une substance pour la faire changer d’état. ↩