La structure de l’atome
Histoire du modèle de l’atome
Dès l’Antiquité, certains philosophes comme Démocrite pensent que la matière est constituée de minuscules particules qu’on appelle atomes. Cependant, ces particules sont beaucoup trop petites pour être détectables avec le matériel de l’époque et cette théorie sera abandonnée pendant plusieurs siècles.
En 1808, suite aux travaux d’Antoine de Lavoisier sur les réactions chimiques, John Dalton reprend le modèle de l’atome : la matière est constituée de différentes sortes d’atomes. Ces atomes se combinent selon certaines proportions pour former les différents composés connus.
Quelques années plus tard, Joseph John Thomson découvre l’électron et fait évoluer le modèle de l’atome : l’atome est une sorte de sphère positive dans laquelle se trouvent des électrons négatifs.
Puis, en 1911, Ernest Rutherford réalise une célèbre expérience en bombardant une feuille d’or avec des particule alpha et en conclut que l’atome est essentiellement vide. Sa charge positive est concentrée dans un minuscule noyau se trouvant au centre de l’atome. Il découvre par la suite que la charge du noyau est due à des particules encore plus petites se trouvant à l’intérieur : les protons.
Finalement, en 1932, James Chadwick découvre une nouvelle particule à l’intérieur du noyau : les neutrons qui n’ont pas de charges électriques.
Entretemps et par la suite, le modèle de l’atome s’améliore encore, notamment grâce aux connaissances en physique quantique…
Structure microscopique de l’atome
Un atome est constitué de plusieurs particules minuscules. Il contient :
- un noyau minuscule (
 ) qui se
trouve au centre et qui est environ 100 000 fois plus petit que l’atome
(l’atome fait environ 0,1 nm) ;
) qui se
trouve au centre et qui est environ 100 000 fois plus petit que l’atome
(l’atome fait environ 0,1 nm) ; - des électrons (
 ) qui
forment un « nuage » autour du noyau (les électrons se déplacent et n’ont pas
de position déterminée). Ils sont beaucoup plus petits que le noyau et
ont chacun une charge électrique négative.
) qui
forment un « nuage » autour du noyau (les électrons se déplacent et n’ont pas
de position déterminée). Ils sont beaucoup plus petits que le noyau et
ont chacun une charge électrique négative.
Le noyau est lui-même constitué de particules encore plus petites qu’on appelle des nucléons. Il en existe deux sortes :
- les protons (
 ) qui ont
chacun une charge électrique positive ;
) qui ont
chacun une charge électrique positive ; - les neutrons (
 ) qui
n’ont pas de charge électrique (on dit qu’ils sont neutres
électriquement).
) qui
n’ont pas de charge électrique (on dit qu’ils sont neutres
électriquement).
Tout l’espace qui se trouvent entre les particules est « constitué » de vide (de rien).
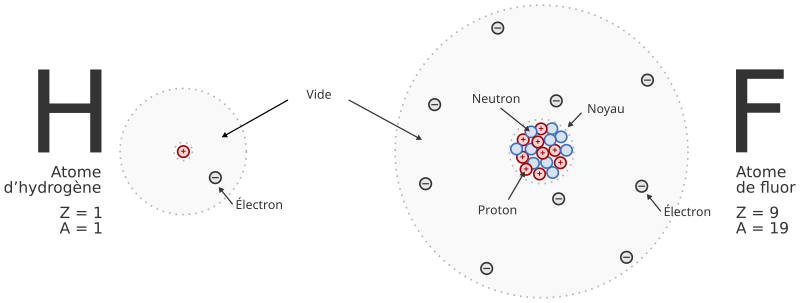
Un atome contient toujours autant de protons que d’électrons ce qui fait que sa charge électrique vaut zéro. On dit que l’atome est neutre électriquement.
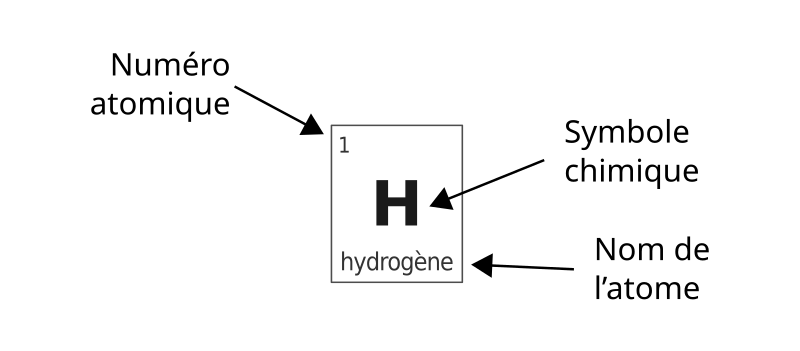
Il de nombre existe 118 types d’atomes qui diffèrent par le nombre de protons qu’ils contiennent. Le nombre de protons dans un atome est appelé le numéro atomique et on le note \(Z\) (on le trouve dans le tableau périodique).
Les atomes d’un même type (on dit un même élément) ont toujours le même nombre de protons mais peuvent avoir un nombre de neutrons différents. Deux atomes du même type qui ont un nombre de neutrons différent sont appelés des isotopes.
Le nombre de neutrons est rarement indiqué (pour des raisons historiques). On indique plutôt le nombre total de particules dans le noyau (protons + neutrons) par un nombre appelé le nombre de masse et noté \(A\). On peut déduire le nombre de neutrons \(N\) en faisant une soustraction : \(N = A − Z\).
Structure des ions
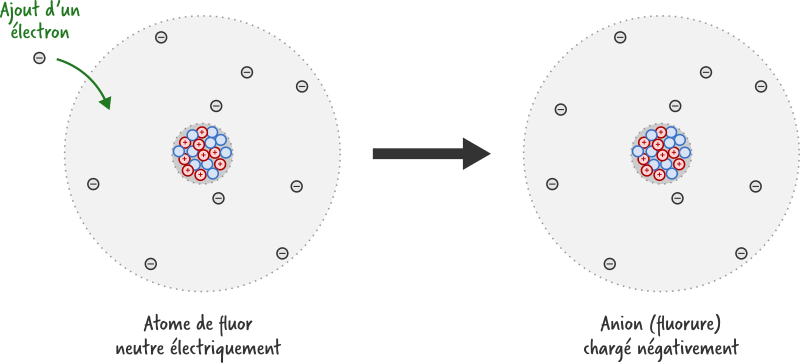
Un ion monoatomique est un atome qui a gagné ou perdu un ou plusieurs électrons. Sa structure s’obtient donc facilement à partir de celle de l’atome en enlevant ou ajoutant des électrons.
Si l’atome gagne des électrons, on obtient un ion négatif (un anion).
Si l’atome perd des électrons, on obtient un ion positif (un cation).