Les mélanges

Corps purs et mélanges
Parmi les substances qu’on rencontre en chimie, on distingue deux grandes familles.
Les corps purs
Les corps purs sont des substances qui ne contiennent qu’un seul constituant, c’est-à-dire une seule sorte de molécules.
Un corps pur peut être solide (par exemple le sucre ne contient que des molécules de saccharose), liquide (par exemple l’eau distillée ne contient que des molécules d’eau) ou gazeux (par exemple le dioxyde de carbone des bouteilles utilisées pour faire de l’eau pétillante ne contient que des molécules de dioxyde de carbone).
Il est très rare de trouver des corps purs dans la nature.
Les mélanges
Les mélanges sont des substances qui contiennent plusieurs constituants, c’est à dire plusieurs sortes de molécules.
Si on parvient à distinguer plusieurs constituants dans le mélange (pas forcément tous mais au moins deux), on dit que le mélange est hétérogène.
Si on ne parvient pas à distinguer les constituants du mélange — on ne voit qu’un seul constituant — on dit que le mélange est homogène.

La notion de mélange homogène ou hétérogène dépend de l’échelle à laquelle on se trouve. Par exemple à l’œil nu, le lait est un mélange homogène, on ne distingue qu’un seul constituant. Mais si on le regarde au microscope, on peut appercevoir des agrégats de protéines. Le mélange est alors hétérogène.
La grande majorité des substances se trouvant dans la nature sont des mélanges.
L’air
L’air est un exemple important de mélange gazeux puisqu’il s’agit du gaz que nous respirons quotidiennement. Il est composé de 78 % de diazote, 21 % de dioxygène1, 1 % d’argon et de nombreux autres gaz dans des proportions très faibles (moins d’un demi dizième de pourcent par exemple pour le dioxyde de carbone).
Si on prélevait une centaine de molécules d’un échantillon d’air, on y trouverait donc 78 molécules de diazote, 21 molécules de dioxygène et 1 atome d’argon2 :

Remarque : ces proportions sont celles de l’air sec mais l’air est en général humide et contient une proportion variable de vapeur d’eau : de 0 à 7 %.
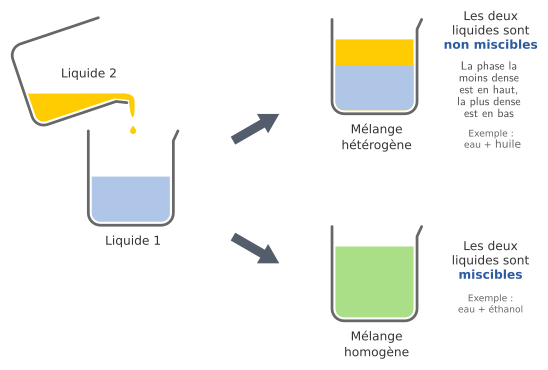
Mélanges liquide-liquide
Lorsqu’on mélange deux liquides, on peut obtenir deux résultats différents : soit le mélange est homogène, soit il est hétérogène.
Lorsque deux liquides forment un mélange homogène, on dit que ces liquides sont miscibles.
Par exemple l’eau et l’alcool sont miscibles.
À l’inverse, lorsque deux liquides forment un mélange hétérogène, on dit que ces liquides sont non-miscibles.
Il se forme alors plusieurs phases dont l’ordre dépend de la densité : le liquide le plus dense se trouve en dessous.
Par exemple l’eau et l’huile sont non-miscibles.
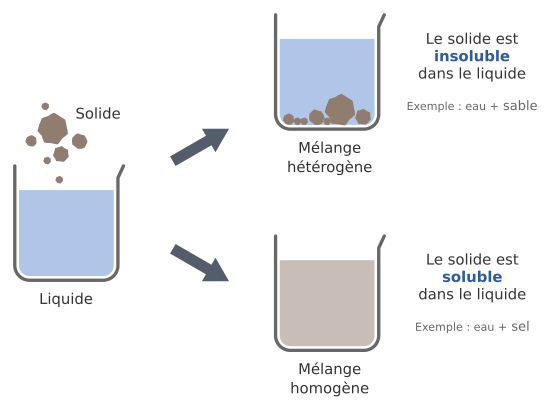
Mélanges solide-liquide
Lorsqu’on mélange un solide et un liquide, on peut également obtenir deux résultats différents : soit le mélange est homogène, soit il est hétérogène.
Lorsqu’un liquide et un solide forment un mélange homogène, on dit que le solide est soluble dans ce liquide. La réalisation de ce mélange s’appelle une dissolution (on dit qu’on dissout le solide dans le liquide3).
Par exemple, le sel et le sucre sont solubles dans l’eau.
À l’inverse, lorsqu’un liquide et un solide forment un mélange hétérogène, on
dit que le solide est insoluble dans ce liquide.
Si le solide est plus dense
que le liquide, il va couler au fond du récipient, sinon il va flotter.
Par exemple, le sel est insoluble dans l’huile ; le sable est insoluble dans l’eau.
Remarque : quand on dit qu’un solide est soluble, il faut préciser dans quel liquide car il peut être soluble dans un liquide et insoluble dans un autre.
Solutions
En chimie, on manipule ou on prépare très souvent des mélanges. On utilise donc un vocabulaire spécifique pour les désigner.
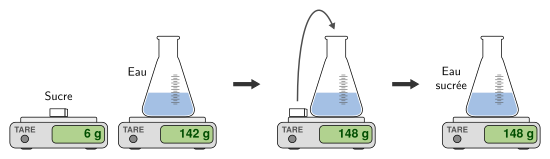
Une solution est le mélange homogène obtenu en dissolvant une substance danc un liquide.
Le liquide s’appelle alors le solvant et la substance dissoute le soluté.
Le soluté peut être un solide (par exemple le sel dans l’eau salée), un liquide (par exemple de l’acide sulfurique dilué dans l’eau) ou un gaz (par exemple le dioxyde de carbone de l’eau pétillante).
Le cas où le solvant est de l’eau est très courant, on appelle alors la solution une solution aqueuse.
Solubilité
La solubilité d’une substance dans un liquide est la masse maximale (en grammes) de cette substance qu’on peut dissoudre dans un litre de liquide. Elle s’exprime en gramme par litre (g/l). On la note généralement \(s\).
Par exemple, on peut dissoudre 2005 g de sucre dans un litre d’eau (à 20 °C). La solubilité du sucre dans l’eau est donc de 2005 g/l.
Remarques :
- une solution qui atteint sa limite de solubilité est saturée. Le soluté supplémentaire qui est ajouté ne se dissout plus (si on ajoute par exemple 2006 g de sucre dans un litre d’eau à 20 °C, 2005 g vont se dissoudre et 1 g restera non dissout sous forme solide).
- la solubilité dépend de la température (elle augmente généralement si on chauffe4).
Lors d’une dissolution, la masse se conserve (la masse de la solution est égale à la somme des masses du solvant et du soluté).
Notes
-
Le dioxygène est le gaz indispensable à la respiration. C’est aussi le comburant le plus courant dans les combustions. ↩
-
L’atome d’argon ne s’assemble pas avec d’autres atomes pour former des molécules. ↩
-
Attention, il est fréquent de confondre la dissolution et la fusion dans le langage courant : on dit souvent que le sucre « fond » dans l’eau mais c’est faux, il se dissout. La fusion est un changement d’état. ↩
-
Lorsque le soluté est un gaz, la solubilité diminue quand on chauffe. ↩