La structure microscopique de la matière
L’idée que la matière puisse être faite de petites particules minuscules est ancienne. Certains philosophes grecs le pensaient déjà au Ve siècle avant notre ère (comme Démocrite par exemple).
Cependant, il a fallu attendre le début du XXe siècle pour pouvoir le démontrer expérimentalement. Parmi les scientifiques les plus célèbres, il y a Albert Einstein qui a l’idée d’expliquer en 1905 le mouvement aléatoire de grains de pollen dans l’eau par des collisions avec des particules minuscules et invisibles : les molécules. Puis il faut encore attendre encore quelques années pour que Jean Perrin valide l’interprétation d’Einstein. Il recevra d’ailleurs le prix Nobel pour ces travaux.
Corps pur et mélange
Les molécules sont extrêmement petites1 : on ne peut ni les voir à l’œil nu, ni même avec un microscope. Elles sont séparées par du vide.
Il existe une infinité de sortes de molécules différentes qui ont parfois des formes compliquées à représenter. Pour simplifier, on peut représenter une molécule par une forme géométrique simple (par exemple un cercle, un carré, un triangle, etc.) à condition d’ajouter une légende précisant ce que chaque forme représente.
Au niveau microscopique, un corps pur est une substance constituée d’une seule sorte de molécules.
Un mélange est une substance constituée de plusieurs sortes de molécules.
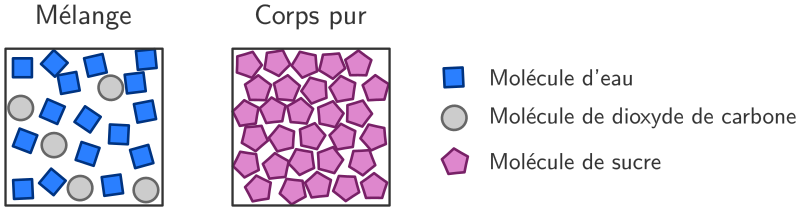
Toutes les molécules d’une même sorte, ou d’un même type sont toutes parfaitement identiques. On ne peut pas les distinguer. Par exemple une molécule d’eau prélevée au hasard dans un verre d’eau sur Terre est exactement identique à une autre molécule d’eau prélevée au hasard dans l’atmosphère de la planète Neptune.
États de la matière
Les différents états physiques d’une substance dépendent uniquement de la façon dont sont organisées les molécules les unes par rapport aux autres. Dans chaque état physique, les molécules restent les mêmes.
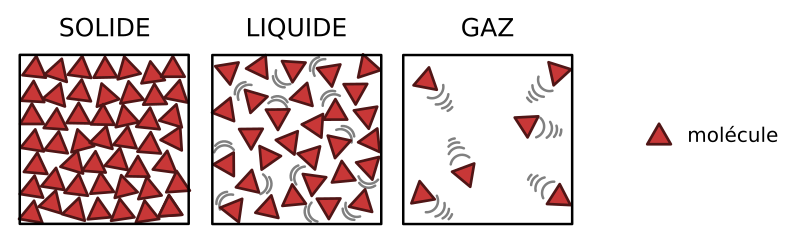
À l’état solide, les molécules sont entassées de façon compacte, elles sont liées et immobiles (elles vibrent en restant à leur place). Cela explique pourquoi un solide a une forme propre.
À l’état liquide, les molécules sont entassées de façon compacte, elles sont liées mais peuvent se déplacer les unes par rapport aux autres. Cela explique pourquoi le liquide prend la forme de son récipient.
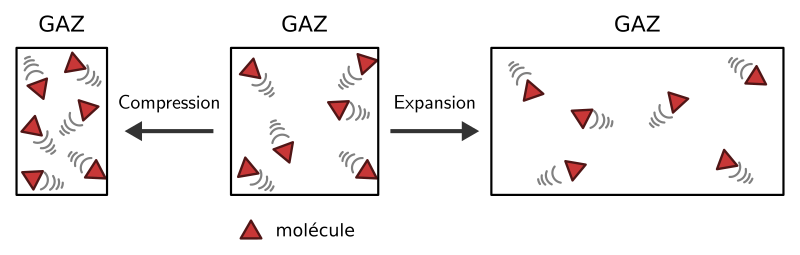
À l’état gazeux, les molécules sont dispersées et éloignées. Elles ne sont pas liées et peuvent se déplacer librement. Cela explique pourquoi le gaz occupe tout l’espace disponible. L’espace vide important entre les molécules explique également pourquoi le gaz est compressible et extensible.
Changement d’état
Lorsqu’on chauffe une substance, ses molécules s’agitent de plus en plus. Inversement, si on refroidit la substance, ses molécules s’agitent de moins en moins2.
En chauffant un solide, les molécules vont vibrer de plus en plus fort jusqu’à ce que les molécules se déplacent les unes par rapport aux autres. On passe alors à l’état liquide. Si on continue de chauffer le liquide, les molécules vont se déplacer de plus en plus vite jusqu’à ce qu’elles ne soient plus liées entre elles et qu’elles s’éloignent les unes des autres. On passe alors à l’état gazeux.
Dans chaque cas, le changement d’état ne modifie que l’organisation des molécules, il ne modifie pas les molécules elles-mêmes ni leur nombre.
Lors d’un changement d’état, le nombre et le type de molécule ne changent pas. Il y a conservation de la masse.
Par contre le volume de la substance est modifié lors du changement car les molécules ne sont plus espacées de la même façon.
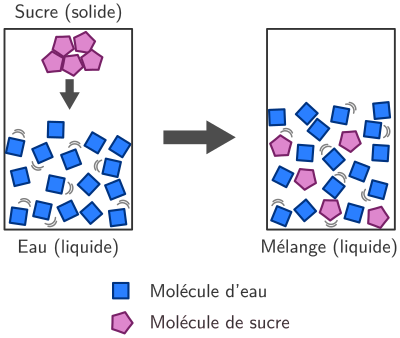
Dissolution
Lors d’une dissolution, les molécules du soluté se dispersent parmi les molécules du solvant.
Comme dans les autres transformations physiques, le nombre et le type de molécule ne changent pas. Il y a conservation de la masse.
Notes
-
Il y a environ 4 millions de milliards de milliards de molécules d’eau dans un verre d’eau. ↩
-
On ne peut pas refroidir indéfiniment une substance car ses molécules vont finir par être « immobiles ». Il existe donc une température minimale qui ne peut être dépassée : le zéro absolu. Cette température vaut –273,15 °C. ↩